《临床检验杂志》
参加新药临床试验就是当“小白鼠”一文让你了
来源:临床检验杂志 【在线投稿】 栏目:综合新闻 时间:2021-07-01作者:美中嘉禾
经常有人问编辑:临床试验的招募是什么?我可以参加吗?如何注册? ……
别着急,小编今天就为大家总结一下,深入了解临床试验,为大家送上干货!
临床试验的安全性如何?
患者问:
什么是临床试验?
编辑的回答:
临床试验是在人类中进行的任何系统研究。试验对象包括患者和健康志愿者。目的是确认或揭示受试药物的作用、不良反应和/或吸收、分布、代谢和排泄,最终确定受试药物的有效性和安全性。
患者问:
哪些新药必须进行临床试验?
给编辑的答复:
国内未生产的药品,国外生产的但在我国未获批的药品,已获批的药品。生产、增加适应症或改变药物的途径和剂量变化均在新药管理范围内,需要进行临床试验研究。
患者问:
试验中使用的新药安全吗?
答案:
一项涉及人类的试验将确保参与试验的患者或健康志愿者的安全和健康。临床试验的审批程序特别严格。在进行临床试验之前,必须进行大量的实验室研究,以获得安全的药物实验数据,技术规范必须获得国家食品药品监督管理局(现国家食品药品监督管理局)的批准。权威)。进行临床试验的医院和医生也必须经过伦理委员会的审查。临床试验需经反复审查批准后方可正式启动。
临床试验的优势是什么?
患者问:
我为什么要参加临床试验?
答案:
临床试验的目的是检验新药的有效性和安全性。因此,临床试验的第一个优势是可以提前使用一些新药,它为一些晚期患者增加了一个选择,也可以帮助那些有病的人和将来会生病的人。另一个好处是临床试验中的药物往往是免费的,有些甚至是有偿的,可以减轻部分治疗疾病的经济负担。
患者问:
平均时间是多久?临床试验是否分阶段进行?
编辑回复:
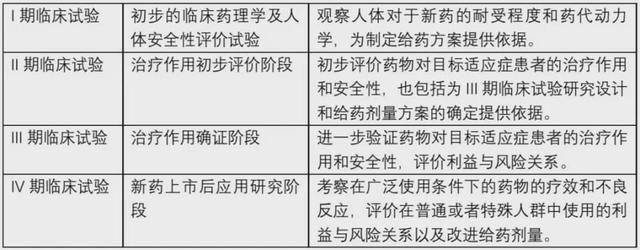
临床试验的时间长短不固定,与设计者的试验设计有关,但一般在半年以上。此外,临床试验有四个阶段,每个阶段都有不同的目的,这也会影响试验的持续时间。这四个阶段及其目的如下表所示。一般临床试验将表明具体阶段。
需要考虑哪些问题?

患者问:
新药肯定有吗?
答案:
新药的可获得性与试验的设计有关。一些受试者可能会被分配到一个对照组,这意味着他们不会接受所研究的治疗,但如果治疗有效,所有受试者将成为第一受益者。
病人问:
情况会不会恶化?
小编的回答:
这种情况也是有可能的,毕竟平时常用的药物不一定有效。临床试验会有更加严谨细致的随访制度,可以比普通药物更敏锐地发现问题。如果病情出现恶化,临床医生一定会及时发现,或对症治疗,终止试验,或按规定给予其他治疗。
患者问:
如果改变主意,中途退出会影响你吗?
编辑回答:
受试者可以随时退出试验,试验前或试验期间均可。当您决定退出试验时,请提前咨询您的医生以确保安全。而且即使你退了,医生还是会提供相应的医疗。值得注意的是,一旦退出,将无法再次加入。当然,退出需要谨慎。一是治疗中断后有病情变化的风险;二是退出会影响临床试验数据的可信度。如果提款超过一定比例,则试验将失败。
最后,如果副作用太大,无法坚持,此时可以如实告诉医生。这不算作退出审判。而且,这部分是需要观察和记录的临床数据。它非常重要,可以帮助更多的患者。不要“不说再见就离开”。
患者问:
参与者需要做什么?
编辑回答:
在决定参加临床试验之前,需要和家人讨论一下参加的利弊。然后了解您要参与的临床试验的具体药物,以及是否符合参与标准。这需要您联系发起临床试验的医生。小编建议,如果方便的话,最好去相应的医院与医生会面沟通。 , 尽可能多地了解与测试相关的信息,例如:有哪些检查和程序?你多久去一次医院?持续多久?你要住院吗?相关费用?我可以知道研究结果吗?对试验过程中出现的意外问题有哪些干预措施? ……
如何参与?
患者问:
如何获取临床试验招募信息?
编辑回复:
您可以登录药物临床试验注册与信息公开平台(src="http://p0.qhimg.com/t014a24e12dbdd0261f.jpg ?size=960x236 "/>
患者问:
我在哪里可以注册?
